 Depositphotos
Depositphotos
Novo estudo revela 4 subtipos de autismo e abre caminho para diagnósticos mais precisos
Um estudo publicado nesta semana na revista Nature Genetics identifi...
 Reprodução / Universidade Federal de Ouro Preto
Reprodução / Universidade Federal de Ouro Preto
Seminário de genética no autismo é anunciado em MG
A Universidade Federal de Ouro Preto (UFOP) e o Instituto Diferente anunciam o I Simpósio de Genét...
 Depositphotos
Depositphotos
Syngap1 traz mais respostas sobre a relação entre autismo e deficiência intelectual
Recentes descobertas científicas ampliaram significativamente o ent...
 Depositphotos
Depositphotos
Esperma paterno pode estar ligado ao autismo, diz pesquisa
A causa do autismo é...
 Reprodução / Tismoo
Reprodução / Tismoo
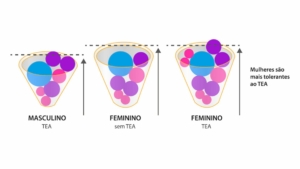
Meninos: ainda são a maioria no TEA
Essa foto é muito intrigante para mim, bem como o modelo que ela representa. Mesmo já tendo escrit...
 Depositphotos
Depositphotos
Maior estudo genômico do autismo revela 134 genes ligados ao TEA
Liderado pelo SickKids, o estudo sequenciou os genomas completos...
 Muotri Lab
Muotri Lab
Estudo abre novas possibilidades de tratamento para forma sindrômica de autismo
Liderado por brasileiros, grupo descobre mecanismo causador da síndrome de Pitt-Hopkins, disfun...
 Reprodução / Universidade de Coimbra
Reprodução / Universidade de Coimbra
Universidade de Coimbra recebe mais de 1 mi para pesquisa sobre autismo
A ERA-Net NEURON está financiando uma pesquisa sobre autismo promovida por um consórcio de pesquis...

Mapeamento genético – Qual exame genético é mais útil, exoma ou array?
Com o objetivo de comparar os exames de microarranjo genômico (tamb...
Unidos por um único gene
Mutações genéticas motivam união de famílias para se apoiarem mutuamente e estimularem a ci�...

